モデルラン藻の糖代謝酵素はラン藻の中で仲間外れ
2018年08月30日
明治大学
モデルラン藻の糖代謝酵素はラン藻の中で仲間外れ
○明治大学大学院農学研究科環境バイオテクノロジー研究室の伊東昇紀(博士前期課程1年)、小山内崇(専任講師)の研究グループは、ラン藻の6-ホスホグルコン酸脱水素酵素という糖代謝酵素の1つのアミノ酸が2つの性質を決定することを明らかにした。
○モデルラン藻であるシネコシスティスの6-ホスホグルコン酸脱水素酵素は、42番目のアミノ酸が同じグループのラン藻と異なり、仲間外れであることがわかった。
○シネコシスティスの6-ホスホグルコン酸脱水素酵素における42番目のアミノ酸の置換は、基質であるNADP+に対する親和性と、阻害剤であるNADPHの阻害様式を変化させた。
植物や藻類と同じ酸素発生型の光合成を行うラン藻という細菌は、増殖が速く、固定した二酸化炭素を単一の炭素源として様々な物質を生産することができます。ラン藻の中でも、取り扱いが容易であり、モデルラン藻として世界中で研究されているシネコシスティス注1)は、現在までに、バイオプラスチックやバイオ燃料の生産に関する研究が盛んに行われています。しかしながら、物質生産に関わる代謝のメカニズムは未だによくわかっておらず、その解明は大きな課題の一つです。
酸化的ペントースリン酸経路は、核酸の構成糖であるペントースや、還元力であるNADPHを供給する経路で、生物において必要不可欠な経路です。酸化的ペントースリン酸経路において、6-ホスホグルコン酸脱水素酵素(6PGDH)は、NADPHの生成反応を担う酵素です。今回、私たちは、シネコシスティスの6PGDH(Sy6PGDH)の特性評価を行いました。
その結果、Sy6PGDHは本来の基質であるNADP+だけでなく、わずかながらNAD+に対しても活性を示すことが分かりました。また、生成物であるNADPHによる阻害様式が、今まで報告されている6PGDHとは異なることが分かりました。立体構造が明らかとなっている2種類の細菌由来6PGDHとSy6PGDHを含むラン藻由来6PGDHで構成アミノ酸を比較した結果、NADP+の結合部位と予想されるアミノ酸(Sy6PGDHでは42番目)が、ラン藻由来6PGDHでは、目というグループごとに保存されていることが分かりました。Sy6PGDHの42番目のアミノ酸はセリンですが、同じ目のラン藻由来6PGDHではスレオニンで保存されていました。そこで、Sy6PGDHの型破りな42番目のセリンの役割を調べるため、スレオニンへと置換した変異型(Sy6PGDH_S42T)を作製し、活性測定を行いました。その結果、Sy6PGDH_S42TはNADP+に対する親和性が向上し、NADPHの阻害様式が変化しました。また、Sy6PGDHの42番目に相当する部位に、Sy6PGDHとは反対の変異(スレオニンをセリンへ)を入れたスピルリナ注2)由来6PGDHでは、NADP+に対する親和性とNADPHの阻害様式の両方で反対の効果が得られました。
このように本研究では、ラン藻の6PGDHという糖代謝酵素の性質を決定する重要なアミノ酸を発見しました。
この研究は、明治大学大学院農学研究科 伊東 昇紀(博士前期課程1年)、小山内崇(専任講師)のグループによって行われました。この研究は、JST戦略的創造研究推進事業先端的低炭素化技術開発ALCA(代表小山内崇)およびJSPS科研費新学術領域研究「新光合成」(領域代表基礎生物学研究所皆川純教授、計画班代表大阪大学清水浩教授)の援助により行われました。
本研究成果は、2018年8月10日の「Plant and Cell Physiology」のオンライン版に掲載されました。
※研究グループ
明治大学 農学部農芸化学科
環境バイオテクノロジー研究室
専任講師 小山内 崇(おさない たかし)
博士前期課程1年生 伊東 昇紀(いとう しょうき)
人口増加や経済成長に伴い、需要が高騰する石油などの化石燃料の枯渇や地球温暖化が懸念される近年、化石燃料の節約や環境負荷低減に向けて、石油由来のプラスチックや燃料の代替として、持続可能な生物由来のものを利用する動きが世界中で強まっています。そうした状況の中で、私たちの研究グループは、光合成によって空気中の二酸化炭素を直接物質生産に利用でき、増殖が速く、食料や土地との競合も少ないラン藻という微生物を用いた物質生産に注目し、研究を行っています。
ラン藻の中でも、遺伝子改変が容易で、凍結保存が可能であるなどの利点から、光合成生物のモデル生物として、世界中で広く研究されているシネコシスティス(Synechocystis sp. PCC 6803)は、現在までに二酸化炭素から様々な物質を生産できることが報告されています。しかしながら、シネコシスティスにおいて、物質生産に至るまでの代謝反応における生化学的知見は乏しく、各反応における制御機構の解明が求められています。
全ての生物が有し、核酸の構成糖や還元力NADPHの供給源である酸化的ペントースリン酸経路は、解糖系から分岐する糖代謝経路です。還元力NADPHは、生体内で様々な還元反応に寄与し、炭素の流れを決定する重要なファクターの一つです。酸化的ペントースリン酸経路の中で、NADPHの生成反応を担う酵素の一つである6-ホスホグルコン酸脱水素酵素(6PGDH)の性質は、大腸菌などの従属栄養細菌や哺乳動物、植物由来のもので盛んに報告されていますが、ラン藻由来のものでは未だに報告されていません。
そこで、本研究では、シネコシスティス由来の6PGDH(Sy6PGDH)を精製し、その性質を調べました。加えて、変異導入により、ラン藻の6PGDHにおいて、目というグループごとに高度に保存されている1つのアミノ酸の役割を明らかにしました。
研究グループは、Sy6PGDHを大腸菌から精製し、その性質を調べました。その結果、Sy6PGDHは、32℃、pH 7.3で最も高い活性を示し、酵素1分子当たりの活性は、現在報告されている6PGDHの中で最高値であることが分かりました。 Sy6PGDHは基質NADP+に特異的でありながら、NAD+にも活性を示すことが分かりました。また、Sy6PGDHは、数ある阻害剤の中でも、生成物であるNADPHによって最も顕著に阻害を受けました。NADPHの阻害様式は今まで報告されていない独自のものであることが分かりました。
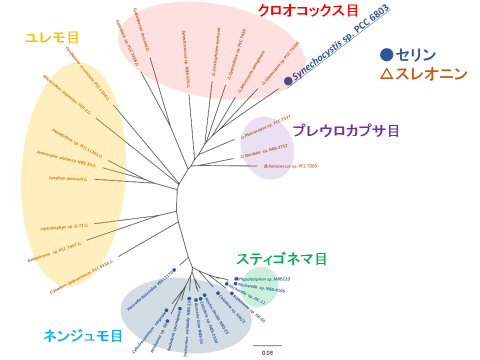
次に、ラン藻由来6PGDHの性質に重要なアミノ酸を特定するために、Sy6PGDHを含めた7種のラン藻由来6PGDHと既に立体構造が明らかとなっている大腸菌と乳酸菌由来の6PGDHの配列を用いて、構成アミノ酸を比較するマルチプルアライメント注3)を行いました。その結果、大腸菌と乳酸菌由来の6PGDHにおいてNADP+の結合部位を構成するアミノ酸(Sy6PGDHの42番目に相当するアミノ酸)が、ラン藻由来6PGDHでも保存されていました(図1)。また、系統解析から、ラン藻では目というグループごとに、Sy6PGDHの42番目に相当するアミノ酸が同じアミノ酸で保存されていることが分かりました(図2)。Sy6PGDH の42番目に相当するアミノ酸は、特殊な窒素固定を行うネンジュモ目とスティゴネマ目ではセリンで保存されており、それ以外のクロオコックス目、ユレモ目、プレウロカプサ目ではスレオニンで保存されていました(図2)。しかしながら、シネコシスティスはクロオコックス目ですが、Sy6PGDHの42番目のアミノ酸はスレオニンではなく、セリンで保存されていました(図2)。そこで、このSy6PGDHの型破りな42番目の残基の役割を明らかにするために、Sy6PGDH の42番目のセリンをスレオニンへと置換した変異型(Sy6PGDH_S42T)を作成し、性質を調べました。
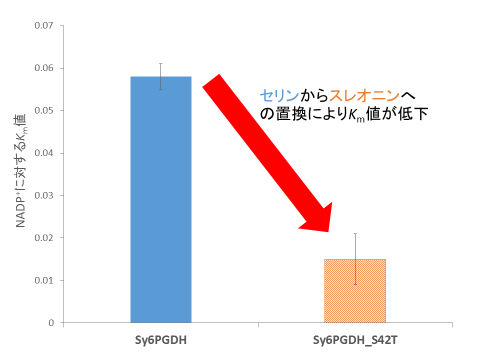
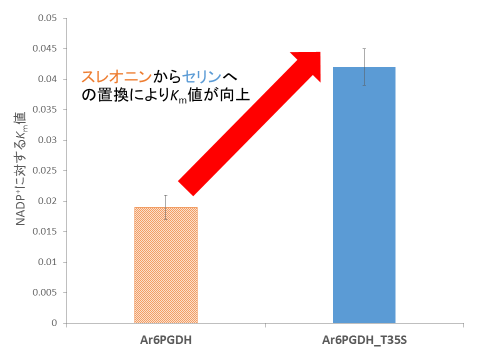
その結果、Sy6PGDH_S42Tは、Sy6PGDHよりもNADP+に対するKm値(親和性の尺度で低いほど親和性が高い)が低く(図3)、NADPHの阻害様式がSy6PGDHと異なることが分かりました。また、Sy6PGDHとは反対に、ユレモ目のスピルリナ(Arthrospira platensis NIES-39)由来6PGDH(Ar6PGDH)の35番目のスレオニン(Sy6PGDHの42番目に相当する部位)をセリンへと置換した変異型(Ar6PGDH_T35S)ではNADP+に対するKm値(図4)とNADPHの阻害様式の両方で反対の効果が得られました。
このように、Sy6PGDH における42番目に相当するアミノ酸は、ラン藻由来6PGDHにおいて、NADP+に対する親和性とNADPHの阻害様式を決定することが判明しました。
本研究グル-プは、世界で初めてラン藻由来の6PGDHの性質を明らかにし、2つの性質を決定する重要なアミノ酸を発見しました。本研究成果は、ラン藻の6PGDHの性質を理解するための基礎科学としてだけでなく、代謝工学によってシネコシスティスから様々な物質を生産するための応用科学としても大いに貢献することが予想されます。今後は、シネコシスティスの代謝酵素のさらなる生化学的な解析を進めることで、大きな課題である代謝メカニズムの解明につながることが期待されます。
<タイトル>
Single Amino Acid Change in 6-Phosphogluconate Dehydrogenase from Synechocystis Conveys Higher Affinity for NADP+ and Altered Mode of Inhibition by NADPH
(日本語タイトル Synechocystis由来の6-ホスホグルコン酸脱水素酵素における単一のアミノ酸変化は、NADP+に対するより高い親和性と変化したNADPHによる阻害様式を示す)
<著者名>
Shoki Ito, Takashi Osanai
<雑誌>
Plant and Cell Physiology
<DOI>
doi:
注1)シネコシスティス
最も広く研究されている淡水性、単細胞性のラン藻。増殖が速く、直径が約1.5マイクロメートルの球形をしている。窒素固定を行わない。1996年に、ラン藻種の中で最初に全ゲノム配列が決定された。相同組換えによる遺伝子の改変が可能であり、凍結保存が可能であるなどの利点を有する。
注2) スピルリナ
淡水性、単細胞性のラン藻で、長さが300~500マイクロメートルのらせん形をしている。高温、高アルカリ、高塩濃度下での生育が可能。ラン藻の中で唯一工業的生産が行われており、食品や色素の生産に利用されている。
注3) マルチプルアライメント
DNAの塩基配列あるいはタンパク質のアミノ酸配列に関して、3つ以上の配列間で対応する部分が並ぶように整列したもの。この解析の結果に基づいて、分子系統樹を推定することができる。
<発表者> ※研究内容については発表者にお問い合わせ下さい
明治大学
農学部農芸化学科
環境バイオテクノロジー研究室
専任講師 小山内 崇(おさない たかし)
TEL:044-934-7103 FAX:044-934-7103
<機関窓口>
明治大学 経営企画部 広報課
〒101-8301
東京都千代田区神田駿河台1-1
TEL:03-3296-4082 FAX:03-3296-4087
E-mail: koho@mics.meiji.ac.jp

○モデルラン藻であるシネコシスティスの6-ホスホグルコン酸脱水素酵素は、42番目のアミノ酸が同じグループのラン藻と異なり、仲間外れであることがわかった。
○シネコシスティスの6-ホスホグルコン酸脱水素酵素における42番目のアミノ酸の置換は、基質であるNADP+に対する親和性と、阻害剤であるNADPHの阻害様式を変化させた。
要旨
酸化的ペントースリン酸経路は、核酸の構成糖であるペントースや、還元力であるNADPHを供給する経路で、生物において必要不可欠な経路です。酸化的ペントースリン酸経路において、6-ホスホグルコン酸脱水素酵素(6PGDH)は、NADPHの生成反応を担う酵素です。今回、私たちは、シネコシスティスの6PGDH(Sy6PGDH)の特性評価を行いました。
その結果、Sy6PGDHは本来の基質であるNADP+だけでなく、わずかながらNAD+に対しても活性を示すことが分かりました。また、生成物であるNADPHによる阻害様式が、今まで報告されている6PGDHとは異なることが分かりました。立体構造が明らかとなっている2種類の細菌由来6PGDHとSy6PGDHを含むラン藻由来6PGDHで構成アミノ酸を比較した結果、NADP+の結合部位と予想されるアミノ酸(Sy6PGDHでは42番目)が、ラン藻由来6PGDHでは、目というグループごとに保存されていることが分かりました。Sy6PGDHの42番目のアミノ酸はセリンですが、同じ目のラン藻由来6PGDHではスレオニンで保存されていました。そこで、Sy6PGDHの型破りな42番目のセリンの役割を調べるため、スレオニンへと置換した変異型(Sy6PGDH_S42T)を作製し、活性測定を行いました。その結果、Sy6PGDH_S42TはNADP+に対する親和性が向上し、NADPHの阻害様式が変化しました。また、Sy6PGDHの42番目に相当する部位に、Sy6PGDHとは反対の変異(スレオニンをセリンへ)を入れたスピルリナ注2)由来6PGDHでは、NADP+に対する親和性とNADPHの阻害様式の両方で反対の効果が得られました。
このように本研究では、ラン藻の6PGDHという糖代謝酵素の性質を決定する重要なアミノ酸を発見しました。
この研究は、明治大学大学院農学研究科 伊東 昇紀(博士前期課程1年)、小山内崇(専任講師)のグループによって行われました。この研究は、JST戦略的創造研究推進事業先端的低炭素化技術開発ALCA(代表小山内崇)およびJSPS科研費新学術領域研究「新光合成」(領域代表基礎生物学研究所皆川純教授、計画班代表大阪大学清水浩教授)の援助により行われました。
本研究成果は、2018年8月10日の「Plant and Cell Physiology」のオンライン版に掲載されました。
※研究グループ
明治大学 農学部農芸化学科
環境バイオテクノロジー研究室
専任講師 小山内 崇(おさない たかし)
博士前期課程1年生 伊東 昇紀(いとう しょうき)
1.背景
ラン藻の中でも、遺伝子改変が容易で、凍結保存が可能であるなどの利点から、光合成生物のモデル生物として、世界中で広く研究されているシネコシスティス(Synechocystis sp. PCC 6803)は、現在までに二酸化炭素から様々な物質を生産できることが報告されています。しかしながら、シネコシスティスにおいて、物質生産に至るまでの代謝反応における生化学的知見は乏しく、各反応における制御機構の解明が求められています。
全ての生物が有し、核酸の構成糖や還元力NADPHの供給源である酸化的ペントースリン酸経路は、解糖系から分岐する糖代謝経路です。還元力NADPHは、生体内で様々な還元反応に寄与し、炭素の流れを決定する重要なファクターの一つです。酸化的ペントースリン酸経路の中で、NADPHの生成反応を担う酵素の一つである6-ホスホグルコン酸脱水素酵素(6PGDH)の性質は、大腸菌などの従属栄養細菌や哺乳動物、植物由来のもので盛んに報告されていますが、ラン藻由来のものでは未だに報告されていません。
そこで、本研究では、シネコシスティス由来の6PGDH(Sy6PGDH)を精製し、その性質を調べました。加えて、変異導入により、ラン藻の6PGDHにおいて、目というグループごとに高度に保存されている1つのアミノ酸の役割を明らかにしました。
2.研究手法と成果
次に、ラン藻由来6PGDHの性質に重要なアミノ酸を特定するために、Sy6PGDHを含めた7種のラン藻由来6PGDHと既に立体構造が明らかとなっている大腸菌と乳酸菌由来の6PGDHの配列を用いて、構成アミノ酸を比較するマルチプルアライメント注3)を行いました。その結果、大腸菌と乳酸菌由来の6PGDHにおいてNADP+の結合部位を構成するアミノ酸(Sy6PGDHの42番目に相当するアミノ酸)が、ラン藻由来6PGDHでも保存されていました(図1)。また、系統解析から、ラン藻では目というグループごとに、Sy6PGDHの42番目に相当するアミノ酸が同じアミノ酸で保存されていることが分かりました(図2)。Sy6PGDH の42番目に相当するアミノ酸は、特殊な窒素固定を行うネンジュモ目とスティゴネマ目ではセリンで保存されており、それ以外のクロオコックス目、ユレモ目、プレウロカプサ目ではスレオニンで保存されていました(図2)。しかしながら、シネコシスティスはクロオコックス目ですが、Sy6PGDHの42番目のアミノ酸はスレオニンではなく、セリンで保存されていました(図2)。そこで、このSy6PGDHの型破りな42番目の残基の役割を明らかにするために、Sy6PGDH の42番目のセリンをスレオニンへと置換した変異型(Sy6PGDH_S42T)を作成し、性質を調べました。
その結果、Sy6PGDH_S42Tは、Sy6PGDHよりもNADP+に対するKm値(親和性の尺度で低いほど親和性が高い)が低く(図3)、NADPHの阻害様式がSy6PGDHと異なることが分かりました。また、Sy6PGDHとは反対に、ユレモ目のスピルリナ(Arthrospira platensis NIES-39)由来6PGDH(Ar6PGDH)の35番目のスレオニン(Sy6PGDHの42番目に相当する部位)をセリンへと置換した変異型(Ar6PGDH_T35S)ではNADP+に対するKm値(図4)とNADPHの阻害様式の両方で反対の効果が得られました。
このように、Sy6PGDH における42番目に相当するアミノ酸は、ラン藻由来6PGDHにおいて、NADP+に対する親和性とNADPHの阻害様式を決定することが判明しました。
3.今後の期待
4.論文情報
Single Amino Acid Change in 6-Phosphogluconate Dehydrogenase from Synechocystis Conveys Higher Affinity for NADP+ and Altered Mode of Inhibition by NADPH
(日本語タイトル Synechocystis由来の6-ホスホグルコン酸脱水素酵素における単一のアミノ酸変化は、NADP+に対するより高い親和性と変化したNADPHによる阻害様式を示す)
<著者名>
Shoki Ito, Takashi Osanai
<雑誌>
Plant and Cell Physiology
<DOI>
doi:
5.補足説明
最も広く研究されている淡水性、単細胞性のラン藻。増殖が速く、直径が約1.5マイクロメートルの球形をしている。窒素固定を行わない。1996年に、ラン藻種の中で最初に全ゲノム配列が決定された。相同組換えによる遺伝子の改変が可能であり、凍結保存が可能であるなどの利点を有する。
注2) スピルリナ
淡水性、単細胞性のラン藻で、長さが300~500マイクロメートルのらせん形をしている。高温、高アルカリ、高塩濃度下での生育が可能。ラン藻の中で唯一工業的生産が行われており、食品や色素の生産に利用されている。
注3) マルチプルアライメント
DNAの塩基配列あるいはタンパク質のアミノ酸配列に関して、3つ以上の配列間で対応する部分が並ぶように整列したもの。この解析の結果に基づいて、分子系統樹を推定することができる。
6.発表者・機関窓口
明治大学
農学部農芸化学科
環境バイオテクノロジー研究室
専任講師 小山内 崇(おさない たかし)
TEL:044-934-7103 FAX:044-934-7103
<機関窓口>
明治大学 経営企画部 広報課
〒101-8301
東京都千代田区神田駿河台1-1
TEL:03-3296-4082 FAX:03-3296-4087
E-mail: koho@mics.meiji.ac.jp

図1.細菌由来6PGDHのマルチプルアライメント(一部抜粋)
9種の細菌由来6PGDHの構成アミノ酸を、比較のために並べたものです。大腸菌と乳酸菌由来6PGDHで、NADP+の結合部位を構成するアミノ酸(Sy6PGDHの42番目に相当するアミノ酸)が、ラン藻由来6PGDHでも保存されています。

図2.ラン藻由来6PGDHの分子系統樹
ラン藻由来6PGDHの配列に基づいて作成した分子系統樹です。ラン藻由来6PGDHの配列は目というグループごとに分かれます。それぞれの目ごとに、Sy6PGDHの42番目に相当するアミノ酸が、セリンかスレオニンで高度に保存されています。

図3. Sy6PGDHとSy6PGDH_S42TのNADP+に対するKm値
Sy6PGDHでは42番目のアミノ酸をセリンからスレオニンへと置換することで、NADP+に対するKm値が低下します。

図4. Ar6PGDHとAr6PGDH_T35SのNADP+に対するKm値
Ar6PGDHでは35番目のアミノ酸(Sy6PGDHの42番目に相当するアミノ酸)をスレオニンからセリンへと置換することで、NADP+に対するKm値が向上します。






