新しいゲノム編集“TiD”システムの開発に成功しました ~CRISPR-Casサブタイプ Type I-Dを活用~
2020年11月06日
明治大学
新しいゲノム編集“TiD”システムの開発に成功しました
~CRISPR-Casサブタイプ Type I-Dを活用~
~CRISPR-Casサブタイプ Type I-Dを活用~
徳島大学生物資源産業学部 刑部敬史教授らの研究グループはこのたび、世界で初めてサブタイプType I-Dに属するCRISPR-Casが、新たなゲノム編集に活用できることを生体内で示し、これを “TiD”システムと名付けました。明治大学農学部 矢野健太郎教授は、本プロジェクトに参画し、ゲノム編集技術の標的配列について大規模ゲノム情報解析を実施することで、標的配列のオフターゲット変異を評価し、この新規国産ゲノム編集技術であるTiD技術の有用性の検証に貢献しました。
近年、ゲノム編集技術により様々な生物においてゲノムに変異を導入する技術が確立され、基礎研究における遺伝子の機能解明だけでなく、医療分野での遺伝子治療や再生医療、創薬分野での新薬開発や農林水産業分野では様々な品種改良など、幅広い分野での活用とのその発展が期待されています。代表的な技術であるCRIPSPR※-Cas9システムは、微生物の獲得免疫システムとして見出され、その簡便さと高効率な変異導入により広く利用されています。このような多くの分野で活用できる画期的な技術として、本年、CRISPR-Cas9の共同開発者であるジェニファー・ダウドナ博士とエマニュエル・シャルパンティエ博士らはノーベル化学賞を受賞されました。
ゲノム編集技術は、一方で、狙った配列以外が誤って編集されるオフターゲット変異が生じてしまうことや、また、これまでの開発されたゲノム編集技術は、そのほとんどが欧米の研究機関により開発されたものであることから、国内の産業・医療での活用が制限されるという知的財産の課題として、新しい国産のゲノム編集技術の開発が望まれていました。このたび、徳島大学生物資源産業学部 ・刑部敬史教授らのグループは、世界で初めてサブタイプType I-Dに属するCRISPR-Casが、ゲノム編集に活用できることを生体内で示し、これを “TiD”システムと名付けました。また、TiDは、これまでのゲノム編集とは異なり様々な変異タイプを導入できることや、明治大学農学部・矢野健太郎教授との共同研究にて、様々な生物のゲノムにおいてCRISPR-Cas9およびTiDの標的配列の大規模解析を実施し、TiDが既存のゲノム編集技術よりオフターゲット変異の可能性が低いこと示しました。今回は、植物変異体を作製するTiDシステムの活用例を報告しており、様々な産業や農業への分野への応用が期待できます。
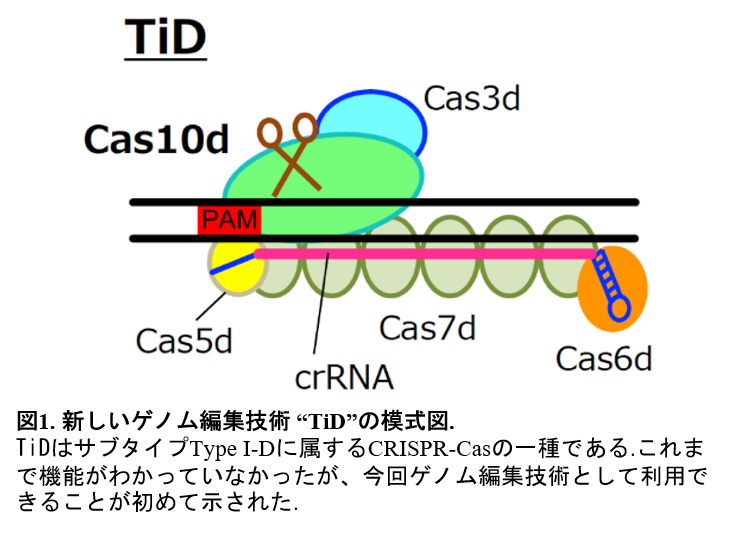
CRIPSR-Cas システムは、最も広範囲に用いられているCRIPSR-Cas9を代表としてさまざまな因子が微生物に存在しており、大きく分類すると、複数のタンパク質因子の複合体がDNAの切断を行うClass1と、Cas9のように、一つのタンパク質因子がDNAを切断するClass2に分類されます。徳島大の刑部らは、多様なCRISPR-Casの中から、CRISPR-Cas のClass1に属し、これまでに機能が不明だったCasタンパク質“Cas10d”をその複合体中に含む、サブタイプTypeI-D(図1)に注目しました。刑部らは、Cas10dが、試験管内や様々な生物の細胞中において標的とするDNAの認識や切断活性を持つこと、さらにゲノム編集技術として利用できることを見出し、これを “TiD”システムと名付けました。
CRISPR-Casでは、複合体中に存在するcrRNA※によりゲノム中の特異的なDNA配列が標的として認識されます。TiDが認識するDNA配列の特徴を解析したところ、crRNAに標的として認識されるDNA配列の長さが35〜36塩基であることが判明しました。これは、既存のゲノム編集技術であるCas9の標的配列の長さ (20塩基) に比べて15〜16塩基も長く、標的配列を認識する際に結合の特異性が強くなり、ゲノム編集の問題点の一つであるオフターゲット変異のリスクを低減できると期待できます。
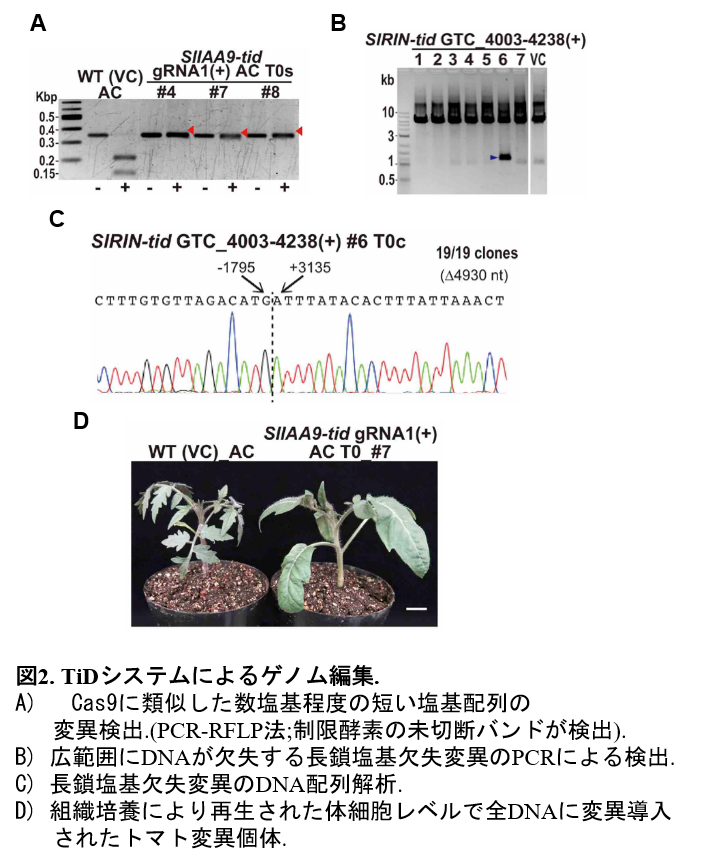
さらに、ヒト細胞および植物細胞を用いてTiDがゲノム編集技術として利用可能かを検証しました。TiD発現ベクターを構築しこれらの細胞へ導入した結果、ヒト細胞での変異検出に続いて、トマト細胞では、CRIPR-Cas9を用いた変異導入でよく見られるような数塩基程度の短い塩基配列の変異と、さらには、数kbから十数kbの広範囲にDNAが欠失する2つのタイプの変異が導入されることが明らかとなりました(図2)。TiDによる植物への変異導入では、体細胞レベルで全てのDNAに変異が導入された変異個体の再生に成功しました(図2)。続いて、オフターゲット変異を解析したところ、短い塩基欠失変異と長い広範囲な塩基欠失変異のどちらも検出されず、さらに、様々な植物種のゲノム配列に対して、計算科学により潜在的なオフターゲットリスクを調べたところ、様々な植物種における大規模ゲノム情報解析により、CRISPR-Cas9と比較してTiDのオフターゲットリスクは低いということが明らかになりました。以上の結果は、TiDシステムがCRISPR-Cas9などの既存のゲノム編集にはない特徴を持つ国産のゲノム編集技術として、効率的なノックアウト変異体作出に有用なゲノム編集ツールであることを示しています。今後、TiDにさらなる改良を行うことにより、医薬、産業、農業分野において様々に応用展開できると期待できます。
本研究は、NEDO(国立研究開発法人新エネルギー・産業技術総合開発機構)の支援により行われました。
 “Genome editing in plants using CRISPR type I-D nuclease”
“Genome editing in plants using CRISPR type I-D nuclease”
Keishi Osakabe*, Naoki Wada, Tomoko Miyaji, Emi Murakami, Kazuya Marui, Risa Ueta, Ryosuke Hashimoto, Chihiro Abe-Hara, Bihe Kong, Kentaro Yano, Yuriko Osakabe*
Communications Biology (2020) doi: 10.1038/s42003-020-01366-6.
※CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats )
真正細菌や古細菌が持つファージなどに対する獲得免疫機構の一つ。標的DNAを認識するRNA分子(crRNAと呼ばれる)およびcrRNAと複合体を形成するCas(CRISPR associated)タンパク質とからなる。現段階では、30種を超える多様なCRISPRシステムが同定されている。
研究の背景と概要
ゲノム編集技術は、一方で、狙った配列以外が誤って編集されるオフターゲット変異が生じてしまうことや、また、これまでの開発されたゲノム編集技術は、そのほとんどが欧米の研究機関により開発されたものであることから、国内の産業・医療での活用が制限されるという知的財産の課題として、新しい国産のゲノム編集技術の開発が望まれていました。このたび、徳島大学生物資源産業学部 ・刑部敬史教授らのグループは、世界で初めてサブタイプType I-Dに属するCRISPR-Casが、ゲノム編集に活用できることを生体内で示し、これを “TiD”システムと名付けました。また、TiDは、これまでのゲノム編集とは異なり様々な変異タイプを導入できることや、明治大学農学部・矢野健太郎教授との共同研究にて、様々な生物のゲノムにおいてCRISPR-Cas9およびTiDの標的配列の大規模解析を実施し、TiDが既存のゲノム編集技術よりオフターゲット変異の可能性が低いこと示しました。今回は、植物変異体を作製するTiDシステムの活用例を報告しており、様々な産業や農業への分野への応用が期待できます。
研究の内容と成果
CRISPR-Casでは、複合体中に存在するcrRNA※によりゲノム中の特異的なDNA配列が標的として認識されます。TiDが認識するDNA配列の特徴を解析したところ、crRNAに標的として認識されるDNA配列の長さが35〜36塩基であることが判明しました。これは、既存のゲノム編集技術であるCas9の標的配列の長さ (20塩基) に比べて15〜16塩基も長く、標的配列を認識する際に結合の特異性が強くなり、ゲノム編集の問題点の一つであるオフターゲット変異のリスクを低減できると期待できます。
さらに、ヒト細胞および植物細胞を用いてTiDがゲノム編集技術として利用可能かを検証しました。TiD発現ベクターを構築しこれらの細胞へ導入した結果、ヒト細胞での変異検出に続いて、トマト細胞では、CRIPR-Cas9を用いた変異導入でよく見られるような数塩基程度の短い塩基配列の変異と、さらには、数kbから十数kbの広範囲にDNAが欠失する2つのタイプの変異が導入されることが明らかとなりました(図2)。TiDによる植物への変異導入では、体細胞レベルで全てのDNAに変異が導入された変異個体の再生に成功しました(図2)。続いて、オフターゲット変異を解析したところ、短い塩基欠失変異と長い広範囲な塩基欠失変異のどちらも検出されず、さらに、様々な植物種のゲノム配列に対して、計算科学により潜在的なオフターゲットリスクを調べたところ、様々な植物種における大規模ゲノム情報解析により、CRISPR-Cas9と比較してTiDのオフターゲットリスクは低いということが明らかになりました。以上の結果は、TiDシステムがCRISPR-Cas9などの既存のゲノム編集にはない特徴を持つ国産のゲノム編集技術として、効率的なノックアウト変異体作出に有用なゲノム編集ツールであることを示しています。今後、TiDにさらなる改良を行うことにより、医薬、産業、農業分野において様々に応用展開できると期待できます。
本研究は、NEDO(国立研究開発法人新エネルギー・産業技術総合開発機構)の支援により行われました。


論文情報
Keishi Osakabe*, Naoki Wada, Tomoko Miyaji, Emi Murakami, Kazuya Marui, Risa Ueta, Ryosuke Hashimoto, Chihiro Abe-Hara, Bihe Kong, Kentaro Yano, Yuriko Osakabe*
Communications Biology (2020) doi: 10.1038/s42003-020-01366-6.
補足説明
真正細菌や古細菌が持つファージなどに対する獲得免疫機構の一つ。標的DNAを認識するRNA分子(crRNAと呼ばれる)およびcrRNAと複合体を形成するCas(CRISPR associated)タンパク質とからなる。現段階では、30種を超える多様なCRISPRシステムが同定されている。
- お問い合わせ先
-
取材に関するお問い合わせ
明治大学経営企画部広報課
TEL:03-3296-4082
MAIL:koho@mics.meiji.ac.jp -
内容に関するお問い合わせ
徳島大学大学院社会産業学理工学研究部教授 刑部 敬史
TEL:088-634-6418
FAX:088-634-6419
MAIL:kosakabe@tokushima-u.ac.jp
教授 刑部祐里子
TEL・FAX:088-656-9310
MAIL:osakabe.yuriko@tokushima-u.ac.jp
CRISPR-Cas9およびTiD標的配列の大規模情報解析について
明治大学農学部教授 矢野 健太郎
MAIL:kyano@meiji.ac.jp


