ラン藻の代謝の一部を試験管内で再現することに成功 ~ラン藻のクエン酸回路の“方向”に影響を及ぼす重要な因子を発見~
2020年12月18日
明治大学
ラン藻の代謝の一部を試験管内で再現することに成功
~ラン藻のクエン酸回路の“方向”に影響を及ぼす重要な因子を発見~
~ラン藻のクエン酸回路の“方向”に影響を及ぼす重要な因子を発見~
明治大学大学院農学研究科環境バイオテクノロジー研究室の伊東昇紀(博士後期課程1年)、小山内崇(准教授)らの研究グループは、シネコシスティスというラン藻のクエン酸回路の方向に影響を及ぼす重要な因子を発見しました。
○ 近年、ラン藻のクエン酸回路の酸化方向と還元方向を利用した物質生産に関する研究が盛んに行われているが、各方向の分岐点となるオキサロ酢酸代謝のしくみが良く分かっていなかった。
○ ラン藻のオキサロ酢酸代謝を試験管の中で再現し、解析することで、クエン酸回路の方向に影響を及ぼす重要な因子を発見した。
○ 本研究で行った「代謝の再構成」は、代謝のしくみを重点的に調べることが出来るため、今後、生物の代謝解析として広く利用されると期待される。
低炭素社会実現に向けて、ラン藻を用いた二酸化炭素からの物質生産が注目されています。ラン藻の中でも、シネコシスティスという種は、物質生産の研究によく利用されています。最近では、シネコシスティスのクエン酸回路の酸化方向と還元方向を利用した物質生産に関する研究が、盛んに行われています。しかしながら、クエン酸回路の方向がどのようにして制御されているかはよく分かっていませんでした。
本研究グループは、シネコシスティスのクエン酸回路の方向に関わるオキサロ酢酸の代謝を、酵素を用いて試験管内で再現し、解析しました。生体内を模倣した様々な条件で、オキサロ酢酸がどのように変換されるか調べることで、pH、マグネシウム、ホスホエノールピルビン酸といったクエン酸回路の方向に影響を及ぼす重要な因子を明らかにしました。
今回用いた代謝解析の手法である「代謝の再構成」は、代謝解析としては比較的簡便であると同時に、個々の代謝を重点的に調べることが出来ます。そのため、今後、生物全般の代謝メカニズムの解明に利用され、貢献すると期待されます。
この研究は、明治大学大学院農学研究科 伊東 昇紀(博士後期課程1年)、小山内 崇(准教授)らのグループによって行われました。JSPS科研費特別研究員奨励費(代表伊東昇紀)、JST戦略的創造研究推進事業先端的低炭素化技術開発ALCA、JSPS科研費基盤B・挑戦的研究(萌芽)(代表小山内崇)およびJSPS科研費新学術領域研究「新光合成」(領域代表基礎生物学研究所皆川純教授、計画班代表大阪大学清水浩教授)の援助により行われました。
本研究成果は、2020年12月6日にイギリス国際科学誌「The Plant Journal」のオンライン版に掲載されました。
私たちが普段、生活の中で利用しているプラスチックや燃料の多くは、化石燃料から作られています。しかしながら、化石燃料の燃焼によって生じる二酸化炭素は、地球温暖化の原因物質となっています。また、化石燃料は、昔の生物の死骸が長い時間かけて堆積したものであり、有限であるため、いずれは使い果たしてしまいます。そのため、代替となる、環境に優しく持続的な物質生産が求められています。そうした状況の中で、注目されているのが、「ラン藻」という光合成を行う細菌を利用した物質生産です。ラン藻は、光合成によって取り込んだ二酸化炭素を原料として、様々な物質を生産することが出来ます。ラン藻の中でも、シネコシスティス注1)という種は、増殖が速く、比較的取り扱いが容易であるため、物質生産における最適な宿主として広く利用されています。
近年では、シネコシスティスのクエン酸回路注2)を利用した物質生産に関する研究が、精力的に行われています。クエン酸回路は、生命活動に必要なエネルギーやアミノ酸の生産に関わる最も重要な代謝経路の1つです。シネコシスティスのクエン酸回路には、「酸化方向」と「還元方向」という2つの方向があり、どちらも物質生産に利用されています。これまでの研究から、各方向の分岐点となる「オキサロ酢酸代謝」(図1)が、クエン酸回路の方向に関わる重要な代謝であることが分かりました。しかしながら、オキサロ酢酸代謝がどのように制御されているかは、ほとんど分かっていませんでした。オキサロ酢酸は、生体内にごく微量しか存在しないため、生体内のオキサロ酢酸代謝を直接解析することは、非常に困難です。
そこで、以前、私たちは、オキサロ酢酸代謝に関わる3種類の酵素を精製し、性質を調べました。ホスホエノールピルビン酸(PEP)からオキサロ酢酸を生成する反応は、マグネシウムの存在下で、ホスホエノールピルビン酸カルボキシラーゼ(PEPC)が担当します(図1)。PEPCの反応によって生じたオキサロ酢酸は、酸化方向では、クエン酸シンターゼ(CS)によってクエン酸に変換されます(図1)。一方、還元方向では、リンゴ酸脱水素酵素(MDH)によってリンゴ酸に変換されます(図1)。これらの酵素の解析から、各酵素の活性の大きさや調節方法が、明らかになりました。しかしながら、これらの解析では、測定方法や条件が酵素によって異なっており、統一されていませんでした。加えて、酵素反応に重要な酵素間の相互作用が一切考慮されていませんでした。そのため、オキサロ酢酸代謝の解析としては不十分であり、これらの課題点を解決した新たな解析を行う必要がありました。
今回、私たちは、世界で初めて、オキサロ酢酸代謝を試験管の中で再現し、解析することに成功しました(図1)。精製したPEPC、MDH、CSを、同じ反応液に入れて、オキサロ酢酸代謝を組み立てました(図1)。生体内を模倣した様々な条件で、オキサロ酢酸が、リンゴ酸とクエン酸のどちらに変換されるか調べました(図1)。酵素反応は、PEPCの基質であるPEPを加えることで、開始しました。反応後に、リンゴ酸とクエン酸の生成比(リンゴ酸/クエン酸)を測定しました。
MDHとCSの活性は、pHに強く依存することが分かっています。そこでまず、様々なpHで、リンゴ酸とクエン酸の生成比を調べました(図2)。その結果、pHが低いほど、リンゴ酸/クエン酸が高くなることが判明しました(図2)。これまでの研究によって、MDHがよく働くpHは、CSがよく働くpHよりも低いことが分かっています。そのため、pHが低いほど、MDHに有利な条件であったと考えられます。
PEPCの反応に必要なPEPとマグネシウムは、MDHとCS活性にも影響を及ぼすことが分かっています。そこで次に、PEPとマグネシウム濃度を下げたときのリンゴ酸とクエン酸の生成比を調べました(図3)。PEP濃度を下げると、リンゴ酸/クエン酸が低下しました(図3)。PEPは、CSの強力な阻害剤として働きます。そのため、PEPの減少によって、CSの活性が著しく向上したと考えられます。一方で、マグネシウム濃度を下げると、リンゴ酸/クエン酸が上昇しました(図3)。マグネシウムは、MDHとCS両方の活性化剤として働きます。今回、各酵素のマグネシウムに対する感受性を、同じ条件で調べた結果、MDHよりもCSの方が、マグネシウムによって活性化されることが判明しました(図4)。
以上の研究から、シネコシスティスのオキサロ酢酸代謝の制御メカニズムが明らかになりました(図5)。pH、マグネシウム、PEPが、クエン酸回路の方向に影響を及ぼす重要な因子であると考えられます(図5)。
本研究グループは、これまで解析が困難とされていたラン藻のオキサロ酢酸代謝を、試験管の中で再現し、解析することに成功しました。酵素を使って代謝を再現し、解析する「代謝の再構成」は、個々の代謝をピンポイントで重点的に調べることが出来る画期的な解析手法です。そのため、ラン藻にとどまらず、生物全般の代謝メカニズムの解明に大いに貢献すると予想されます。また、今後も、ラン藻の物質生産に重要な代謝のしくみを明らかにしていくことで、有用物質のさらなる増産につながり、持続可能なエコ社会の実現に貢献すると期待されます。
Reconstitution of oxaloacetate metabolism in the tricarboxylic acid cycle in Synechocystis sp. PCC 6803: discovery of important factors that directly affect the conversion of oxaloacetate
(日本語タイトル Synechocystis sp. PCC 6803のクエン酸回路におけるオキサロ酢酸代謝の再構成:オキサロ酢酸の変換に直接影響を与える重要な因子の発見)
Shoki Ito, Takumi Hakamada, Tatsumi Ogino, Takashi Osanai
The Plant Journal
doi:10.1111/tpj.15120.
注1)シネコシスティス
最もよく研究されている単細胞性のラン藻。淡水性で、窒素固定を行わない。直径1.5マイクロメートルほどの球形をしている。1996年に、ラン藻としては初めて(生物全体では4番目)、全ゲノム配列が決定された。増殖が速く、遺伝子改変が容易に行え、凍結保存が可能であるなどの利点を有する。これらの利点から、近年では、二酸化炭素からの物質生産などの応用研究においても広く利用されている。学名は、Synechocystis sp. PCC 6803である。
注2)クエン酸回路
酸素呼吸を行う全ての生物が持つ代謝経路。生きるために必要不可欠なエネルギーやアミノ酸の生産に関わる。多くの場合は、時計回りで酸化反応が進み、エネルギーの生産に利用される。生物によっては、反時計回りで還元反応が進むものもあり、発酵や炭酸固定に利用されている。
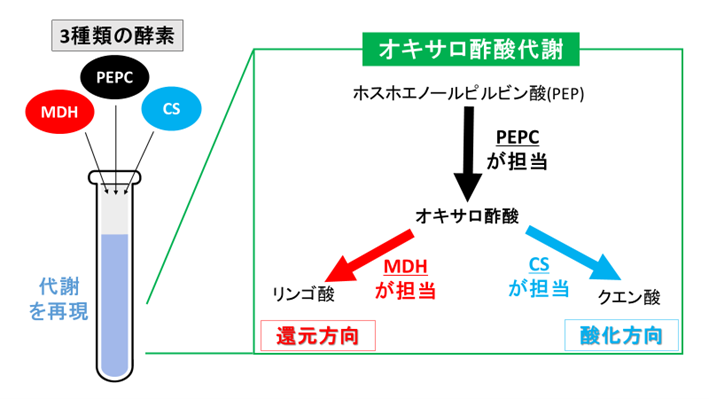
図1. シネコシスティスのオキサロ酢酸代謝の再構成
オキサロ酢酸代謝に関わる3種類の酵素を、同じ反応液に加えて、代謝を再現しました。試験管の中での解析であるため、幅広い条件で、代謝の流れを調べることが出来ます。
○ 近年、ラン藻のクエン酸回路の酸化方向と還元方向を利用した物質生産に関する研究が盛んに行われているが、各方向の分岐点となるオキサロ酢酸代謝のしくみが良く分かっていなかった。
○ ラン藻のオキサロ酢酸代謝を試験管の中で再現し、解析することで、クエン酸回路の方向に影響を及ぼす重要な因子を発見した。
○ 本研究で行った「代謝の再構成」は、代謝のしくみを重点的に調べることが出来るため、今後、生物の代謝解析として広く利用されると期待される。
要旨
本研究グループは、シネコシスティスのクエン酸回路の方向に関わるオキサロ酢酸の代謝を、酵素を用いて試験管内で再現し、解析しました。生体内を模倣した様々な条件で、オキサロ酢酸がどのように変換されるか調べることで、pH、マグネシウム、ホスホエノールピルビン酸といったクエン酸回路の方向に影響を及ぼす重要な因子を明らかにしました。
今回用いた代謝解析の手法である「代謝の再構成」は、代謝解析としては比較的簡便であると同時に、個々の代謝を重点的に調べることが出来ます。そのため、今後、生物全般の代謝メカニズムの解明に利用され、貢献すると期待されます。
この研究は、明治大学大学院農学研究科 伊東 昇紀(博士後期課程1年)、小山内 崇(准教授)らのグループによって行われました。JSPS科研費特別研究員奨励費(代表伊東昇紀)、JST戦略的創造研究推進事業先端的低炭素化技術開発ALCA、JSPS科研費基盤B・挑戦的研究(萌芽)(代表小山内崇)およびJSPS科研費新学術領域研究「新光合成」(領域代表基礎生物学研究所皆川純教授、計画班代表大阪大学清水浩教授)の援助により行われました。
本研究成果は、2020年12月6日にイギリス国際科学誌「The Plant Journal」のオンライン版に掲載されました。
※研究グループ
明治大学 農学部農芸化学科
環境バイオテクノロジー研究室
准教授 小山内 崇(おさない たかし)
博士後期課程1年生 伊東 昇紀(いとう しょうき)
元学部4年生 袴田 匠(はかまだ たくみ)
元学部4年生 荻野 達海(おぎの たつみ)
明治大学 農学部農芸化学科
環境バイオテクノロジー研究室
准教授 小山内 崇(おさない たかし)
博士後期課程1年生 伊東 昇紀(いとう しょうき)
元学部4年生 袴田 匠(はかまだ たくみ)
元学部4年生 荻野 達海(おぎの たつみ)
1.背景
近年では、シネコシスティスのクエン酸回路注2)を利用した物質生産に関する研究が、精力的に行われています。クエン酸回路は、生命活動に必要なエネルギーやアミノ酸の生産に関わる最も重要な代謝経路の1つです。シネコシスティスのクエン酸回路には、「酸化方向」と「還元方向」という2つの方向があり、どちらも物質生産に利用されています。これまでの研究から、各方向の分岐点となる「オキサロ酢酸代謝」(図1)が、クエン酸回路の方向に関わる重要な代謝であることが分かりました。しかしながら、オキサロ酢酸代謝がどのように制御されているかは、ほとんど分かっていませんでした。オキサロ酢酸は、生体内にごく微量しか存在しないため、生体内のオキサロ酢酸代謝を直接解析することは、非常に困難です。
そこで、以前、私たちは、オキサロ酢酸代謝に関わる3種類の酵素を精製し、性質を調べました。ホスホエノールピルビン酸(PEP)からオキサロ酢酸を生成する反応は、マグネシウムの存在下で、ホスホエノールピルビン酸カルボキシラーゼ(PEPC)が担当します(図1)。PEPCの反応によって生じたオキサロ酢酸は、酸化方向では、クエン酸シンターゼ(CS)によってクエン酸に変換されます(図1)。一方、還元方向では、リンゴ酸脱水素酵素(MDH)によってリンゴ酸に変換されます(図1)。これらの酵素の解析から、各酵素の活性の大きさや調節方法が、明らかになりました。しかしながら、これらの解析では、測定方法や条件が酵素によって異なっており、統一されていませんでした。加えて、酵素反応に重要な酵素間の相互作用が一切考慮されていませんでした。そのため、オキサロ酢酸代謝の解析としては不十分であり、これらの課題点を解決した新たな解析を行う必要がありました。
2.研究手法と成果
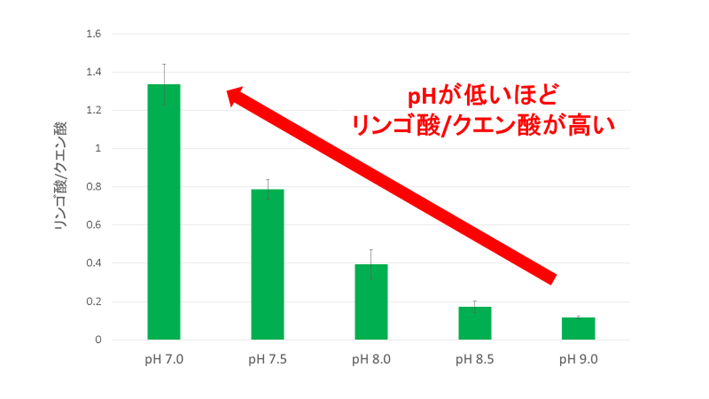
MDHとCSの活性は、pHに強く依存することが分かっています。そこでまず、様々なpHで、リンゴ酸とクエン酸の生成比を調べました(図2)。その結果、pHが低いほど、リンゴ酸/クエン酸が高くなることが判明しました(図2)。これまでの研究によって、MDHがよく働くpHは、CSがよく働くpHよりも低いことが分かっています。そのため、pHが低いほど、MDHに有利な条件であったと考えられます。
PEPCの反応に必要なPEPとマグネシウムは、MDHとCS活性にも影響を及ぼすことが分かっています。そこで次に、PEPとマグネシウム濃度を下げたときのリンゴ酸とクエン酸の生成比を調べました(図3)。PEP濃度を下げると、リンゴ酸/クエン酸が低下しました(図3)。PEPは、CSの強力な阻害剤として働きます。そのため、PEPの減少によって、CSの活性が著しく向上したと考えられます。一方で、マグネシウム濃度を下げると、リンゴ酸/クエン酸が上昇しました(図3)。マグネシウムは、MDHとCS両方の活性化剤として働きます。今回、各酵素のマグネシウムに対する感受性を、同じ条件で調べた結果、MDHよりもCSの方が、マグネシウムによって活性化されることが判明しました(図4)。
以上の研究から、シネコシスティスのオキサロ酢酸代謝の制御メカニズムが明らかになりました(図5)。pH、マグネシウム、PEPが、クエン酸回路の方向に影響を及ぼす重要な因子であると考えられます(図5)。
3.今後の期待
4.論文情報
タイトル
(日本語タイトル Synechocystis sp. PCC 6803のクエン酸回路におけるオキサロ酢酸代謝の再構成:オキサロ酢酸の変換に直接影響を与える重要な因子の発見)
著者名
雑誌
DOI
5.補足説明
最もよく研究されている単細胞性のラン藻。淡水性で、窒素固定を行わない。直径1.5マイクロメートルほどの球形をしている。1996年に、ラン藻としては初めて(生物全体では4番目)、全ゲノム配列が決定された。増殖が速く、遺伝子改変が容易に行え、凍結保存が可能であるなどの利点を有する。これらの利点から、近年では、二酸化炭素からの物質生産などの応用研究においても広く利用されている。学名は、Synechocystis sp. PCC 6803である。
注2)クエン酸回路
酸素呼吸を行う全ての生物が持つ代謝経路。生きるために必要不可欠なエネルギーやアミノ酸の生産に関わる。多くの場合は、時計回りで酸化反応が進み、エネルギーの生産に利用される。生物によっては、反時計回りで還元反応が進むものもあり、発酵や炭酸固定に利用されている。

図1. シネコシスティスのオキサロ酢酸代謝の再構成
オキサロ酢酸代謝に関わる3種類の酵素を、同じ反応液に加えて、代謝を再現しました。試験管の中での解析であるため、幅広い条件で、代謝の流れを調べることが出来ます。

図2. 様々なpHにおけるリンゴ酸とクエン酸の生成比
pH 7-9の範囲では、pHが低いほど、リンゴ酸/クエン酸は高くなります。
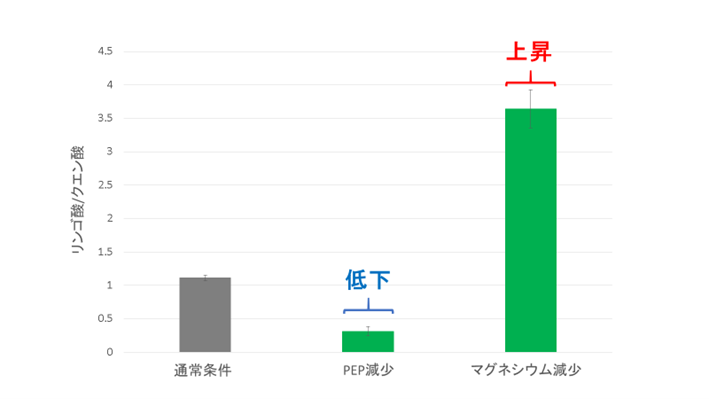
図3. PEPとマグネシウム濃度を下げた時のリンゴ酸とクエン酸の生成比
PEP濃度を下げると、リンゴ酸/クエン酸は低下します。一方で、マグネシウム濃度を下げると、リンゴ酸/クエン酸は上昇します。
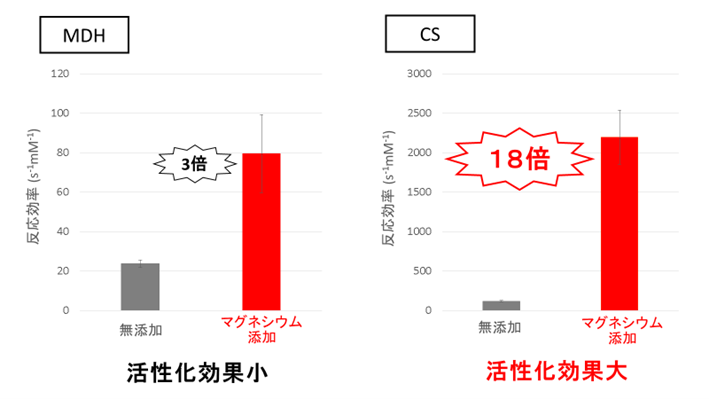
図4. 10 mMマグネシウム存在下のMDHとCSのオキサロ酢酸に対する反応効率
反応効率は、基質を生成物に変換する効率を表します。10 mMマグネシウム存在下で、MDHとCSのオキサロ酢酸に対する反応効率は、それぞれ3倍と18倍に向上します。
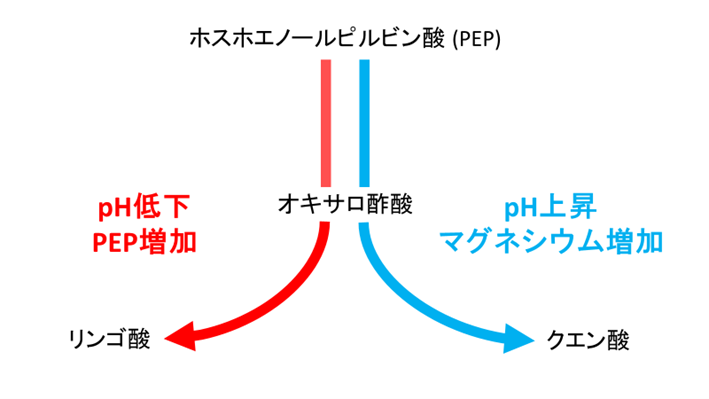
図5 シネコシスティスのオキサロ酢酸代謝の制御モデル
pH、マグネシウム、PEPが、オキサロ酢酸の変換に直接影響を与える重要な因子であると考えられます。
pH 7-9の範囲では、pHが低いほど、リンゴ酸/クエン酸は高くなります。

図3. PEPとマグネシウム濃度を下げた時のリンゴ酸とクエン酸の生成比
PEP濃度を下げると、リンゴ酸/クエン酸は低下します。一方で、マグネシウム濃度を下げると、リンゴ酸/クエン酸は上昇します。

図4. 10 mMマグネシウム存在下のMDHとCSのオキサロ酢酸に対する反応効率
反応効率は、基質を生成物に変換する効率を表します。10 mMマグネシウム存在下で、MDHとCSのオキサロ酢酸に対する反応効率は、それぞれ3倍と18倍に向上します。

図5 シネコシスティスのオキサロ酢酸代謝の制御モデル
pH、マグネシウム、PEPが、オキサロ酢酸の変換に直接影響を与える重要な因子であると考えられます。
- お問い合わせ先
-
発表者 ※研究内容については発表者にお問い合わせ下さい
明治大学
農学部農芸化学科
環境バイオテクノロジー研究室
准教授 小山内 崇(おさない たかし)
TEL:044-934-7103
FAX:044-934-7103 -
機関窓口
明治大学 経営企画部 広報課
〒101-8301
東京都千代田区神田駿河台1-1
TEL:03-3296-4082
FAX:03-3296-4087
E-mail: koho@mics.meiji.ac.jp


