〜二酸化炭素から発酵でつくるプラスチック原料〜 明治大学農学部環境バイオテクノロジー研究室が、 ラン藻のジカルボン酸生産の世界最高レベルを達成しました
2021年03月18日
明治大学
〜二酸化炭素から発酵でつくるプラスチック原料〜
明治大学農学部環境バイオテクノロジー研究室が、
ラン藻のジカルボン酸生産の世界最高レベルを達成しました
明治大学農学部環境バイオテクノロジー研究室が、
ラン藻のジカルボン酸生産の世界最高レベルを達成しました
石油資源の枯渇や温室効果ガスの排出などの環境問題は、人類が立ち向かうべき喫緊の課題です。二酸化炭素を利用できる光合成は、これらの問題解決に貢献できるポテンシャルがあります。
明治大学農学部農芸化学科環境バイオテクノロジー研究室の小山内崇(准教授)、飯嶋寛子(専門研究員)、理化学研究所環境資源科学研究センター近藤昭彦(副センター長、神戸大学教授)、白井智量(副チームリーダー)らの研究グループは、光合成を行うバクテリアであるラン藻を用いて、二酸化炭素からのプラスチック原料生産を行っています。今回の研究では、ラン藻が作るプラ原料であるコハク酸の生産量を世界最高レベルに向上させました。
● ラン藻は酸素のない発酵条件で、プラ原料であるコハク酸などの化合物を細胞外に放出する。
● コハク酸生産に関わる酵素の遺伝子改変と、発酵法の改良を組み合わせ、コハク酸の生産量を向上させた。
● 発酵時の生成物や培地の酸性化が、コハク酸生産の抑制要因となっていることが明らかになったため、今後はさらなる培養方法の改変で、プラ原料生産の向上が期待される。
ラン藻は光合成を行うバクテリアで、大気中の二酸化炭素と光エネルギーを利用することができます。ラン藻は、植物や他の藻類よりも増殖が早いことから、二酸化炭素を使ったバイオテクノロジーへの利用が期待されています。一口にラン藻とっても、様々な種類のラン藻がいますが、そのなかでもシネコシスティス注1)(学名Synechocystis sp.)は、古くから使われている最も利用しやすいラン藻です。シネコシスティスは、遺伝子改変や培養のしやすさから、世界中で研究対象に選ばれています。
ラン藻の細胞内では、光合成で取り込まれた二酸化炭素は、グリコーゲンという糖の形で蓄積されます。このグリコーゲンは炭素の貯蔵源であり、細胞内で様々な化合物に変換されます。過去に研究チームは、シネコシスティスを発酵させることで、細胞内のグリコーゲンが、コハク酸や乳酸などの化合物に変換されることを発見しました。しかも、発酵中に生成されたコハク酸や乳酸は、細胞外に排出されるため、細胞を壊すことなく取り出すことができます。このコハク酸や乳酸は、バイオプラの原料となる物質です。これらの化合物からできたプラスチックは生分解性もあることから、環境技術への応用が期待されています。また、コハク酸に類似した化合物であるフマル酸やリンゴ酸も様々な化学工業原料として使われます。コハク酸、フマル酸、リンゴ酸は、2つのカルボキシル基(-COOH)を持つ化合物であることから、まとめて「ジカルボン酸」と呼ばれています。
今回研究チームは、遺伝子改変と発酵法の工夫により、コハク酸などのプラ原料の生産量を向上させることに成功しました。リンゴ酸デヒドロゲナーゼ(MDH)は、コハク酸を生産する前段階の反応を触媒する酵素です。研究チームは、このMDH(遺伝子名citH)を細胞内で増やした遺伝子改変株(CitHox株)を作製しました。このCitHox株を発酵させたところ、細胞外に放出されるコハク酸、フマル酸、リンゴ酸の3つのジカルボン酸の量が増えることがわかりました。
さらに研究チームは、発酵時の細胞量を増加させると、コハク酸などの生産量が増加することがわかりました。しかし、細胞量を増やした割には生産量が上がらなかったため、その原因を調べたところ、コハク酸の生産が、生成されたコハク酸そのものと培地の酸性化で、抑制されることを見出しました。この生産抑制を避けるため、研究チームは発酵中に培地を交換する“ストリッピング法”を開発しました。このストリッピング法を試したところ、コハク酸、フマル酸、リンゴ酸の量がそれぞれ4.2, 2.7, 4.6 g/Lで生産されました。これは、ラン藻を用いたジカルボン酸生産の最高記録であり、この結果より、二酸化炭素から効率的に付加価値のある化合物が生産できる可能性が示されました。
この研究は、明治大学農学部 小山内崇(准教授)、飯嶋寛子(専門研究員)、理化学研究所環境資源科学研究センター近藤昭彦(チームリーダー、神戸大学教授)、白井智量(副チームリーダー)らによって行われました。この研究は、JST戦略的創造研究推進事業先端的低炭素化技術開発ALCA,科研費基盤B、挑戦的研究萌芽(代表小山内崇)およびJSPS科研費新学術領域研究「新光合成」(領域代表基礎生物学研究所皆川純教授、計画班代表大阪大学清水浩教授)の援助により行われました。本研究成果は、2021年3月17日発行の米国科学誌「Metabolic Engineering」のオンライン版に掲載されました。
石油資源の枯渇や温室効果ガスの排出は、人間社会が避けて通れない重大な課題です。最近では、ESG投資(Environment環境、Society社会、Governance企業統治)などの言葉も生まれ、環境に配慮しない企業は、イメージのみならず融資を受けられないといった経済的なダメージを受けるようになってきました。これらの課題解決には、再生可能エネルギーを利用した持続可能なものづくりが求められています。再生可能エネルギーの中で、生物を用いたバイオテクノロジーでは、太陽や風力などの他のエネルギーでは作れない、複雑な化合物を生産することが可能です。
植物、藻類、細菌が行うことができる光合成は、光エネルギーを用いて大気中の二酸化炭素を細胞内に取り込む反応です。光合成では、二酸化炭素を取り込むことで、グリコーゲンやデンプンといった糖を作ります。これらの糖は、炭素の貯蔵源であり、光合成をする生物は必要に応じてこの糖を様々な化合物に変換します。光合成というと植物が最も有名ですが、藻類や細菌なども光合成を行うことができます。光合成を行う生物の中で、最も増殖が速く、扱いやすいのがラン藻です。ラン藻は、細菌であり、別名シアノバクテリア、アオコとも呼ばれています。ラン藻は光合成によってグリコーゲンを蓄積し、必要に応じて様々な化合物を作り出します。
ラン藻の中でも最も研究されているのが、シネコシスティス(Synechocystis sp.)というラン藻です。シネコシスティスは増殖が速いだけではなく、遺伝子の改変が可能であることから、遺伝子改変株を作製したバイオテクノロジーに利用することができます。過去に研究チームは、このシネコシスティスを発酵させることで、蓄積したグリコーゲンがコハク酸や乳酸などの有機酸に変換されることを発見しました注2)。発酵とは、外部の酸素を除いて培養することです。酵母の発酵ではエタノール、乳酸菌の発酵では乳酸が作られることはよく知られています。シネコシスティスの発酵では、コハク酸や乳酸が作られ、これらは細胞外に放出されます。細胞外に放出されるということは、作られた物質を集める際に細胞を壊す必要がないことを意味します。すなわち、シネコシスティスは、コハク酸や乳酸などを作るのに適した生物であることがわかります。
コハク酸は、炭素が4つの化合物であり、カルボキシ基(-COOH)を2つ持つ物質です。カルボキシ基を持つ物質は、まとめてカルボン酸と呼ばれます。コハク酸はこの2つのカルボキシ基を持つため、ジカルボン酸と呼ばれています。4つの炭素を持つジカルボン酸には、他にもフマル酸やリンゴ酸などがあります。これらコハク酸、フマル酸、リンゴ酸などのジカルボン酸は、バイオプラ原料、他の化合物を作る原料、酸味料、pH調整剤など、工業や食品で幅広く使われます。特にコハク酸は、フィルムや一般的なプラスチック製品に使われるポリブチレンサクシネート(PBS)というプラスチック原料になります。PBSは、生分解性を有するプラスチックです。これまでこのPBSは石油を原料として作られてきましたが、近年は生物を使ったバイオPBS生産が、世界的な競争になっています。このように、コハク酸をはじめとするジカルボン酸の生産の研究開発は、バイオテクノロジーの分野で非常に有望な分野と言えます。
今回研究チームは、遺伝子改変と発酵法の改良することで、シネコシスティスを用いたジカルボン酸の増産に成功しました。また、コハク酸の生産阻害要因などを明らかにし、ジカルボン酸の生産メカニズムについても明らかにしました。
今回研究チームは、リンゴ酸デヒドロゲナーゼ(MDH, 遺伝子名citH)に着目しました。MDHは、クエン酸回路の酵素で、オキサロ酢酸からリンゴ酸を作る反応を触媒します。シネコシスティスの発酵では、オキサロ酢酸からリンゴ酸→フマル酸→コハク酸の順番に生産されます。このことから、MDHは、発酵によるジカルボン酸生産に重要な酵素です。また、このMDHは、オキサロ酢酸からリンゴ酸を作る反応も、リンゴ酸からオキサロ酢酸を作る反応も触媒することができますが、シネコシスティスのMDHはオキサロ酢酸からリンゴ酸を作る反応を効率的に触媒する酵素であることがわかっています注3)。この知見から、シネコシスティスのMDHを増強することで、リンゴ酸、フマル酸、コハク酸の生産が増加する可能性が考えられました。そこで今回、研究チームは、シネコシスティス細胞内で、リンゴ酸デヒドロゲナーゼ遺伝子citHを強く発現させたCitHox株を作製しました。
まず、遺伝子改変していない野生株とCitHox株を、光を当てた条件で培養して光合成をさせ、グリコーゲンを蓄積させました。培養条件などを調節することで、野生株とCitHox株の両株は、細胞の乾燥重量の約50%のグリコーゲンを蓄積できることがわかりました(図1)。このグリコーゲンが蓄積した細胞を発酵条件で培養しました。発酵は、細胞を濃縮してバイアル瓶につめ、窒素で酸素を追い出すことで、低酸素条件にします。この後、ゴム栓で密閉し、アルミホイルで瓶を包むことで、酸素がない発酵条件となります。
最初は、遺伝子改変の効果を調べるために、細胞量を少なくして発酵を行いました。3日間の発酵後に、細胞外に放出されたカルボン酸の量を調べたところ、コハク酸、フマル酸、リンゴ酸の3つのジカルボン酸が、CitHox株では野生株よりも多いことがわかりました(図1)。反対に、乳酸と酢酸の量は、CitHox株では野生株よりも少ないことが明らかになり(図1)、この株は、炭素が4つのジカルボン酸を生産することに適した株であることがわかりました。
次に、さらにジカルボン酸の生産量を上げるために、研究チームは、発酵に使う細胞量を増やした高密度条件でのラン藻の発酵を行いました。高密度で発酵させることで、必要な培養液の量が減るとともに生成物も回収しやすくなるため、より実用的になります。研究チームが、細胞量を10倍にして発酵を行ったところ、生産されるジカルボン酸の量は増えましたが、10倍にはなりませんでした。このため、高密度にした際には、何らかの要因でジカルボン酸の生産が阻害されていることが示唆されました。
研究チームは、ジカルボン酸の生産の阻害要因として、2つの可能性を考えました。1つ目は生成物阻害と呼ばれる現象で、その名の通り、生成された物質(今回の場合はカルボン酸)が、途中の反応を妨害したり、細胞にダメージを与えるなどすることにより、生産量が低下させるというものです。2つ目は、培地の酸性化です。発酵によってラン藻が生産する物質はカルボン酸ですが、文字通り、これらは“酸”であるため、発酵中に培地を酸性化させます。このpHの酸性化は、発酵に大きな影響を与えることが知られていますが、今回の場合は溶液中の炭素のイオン化状態が変化するため、ジカルボン酸の生産量が低下することが予想されました。
そこで研究チームは2つの実験を行いました。まず、予めコハク酸(正確にはコハク酸ナトリウム)を入れておきながら発酵させ、コハク酸による生成物阻害を調べる実験です。この結果、コハク酸があると、発酵時のコハク酸生産量が低下することがわかりました(図2a)。一方、フマル酸やリンゴ酸は生産量が低下しませんでした(図2a)。次に、発酵を通常のpH7.8からpH=1だけアルカリにしたpH8.8の条件で発酵を行いました。その結果、コハク酸、フマル酸、リンゴ酸の3つの生産量が増加しました(図2b)。このように、コハク酸、フマル酸、リンゴ酸に関しては、培地の酸性化が生産の阻害となっていることがわかりました。pHを8.8にした条件では、CitHox株で、コハク酸の生産量が2.5 g/Lと、非常に高いレベルであることが明らかになりました(図2b)。
このように、発酵中の生成物や酸性化によってコハク酸などの生産量が落ちることがわかったため、研究チームは、発酵中に培地を新しくする“ストリッピング法”を開発しました。このストリッピング法では、1日ごとに発酵の培地を新しくして、合計4日間発酵させました(図3)。その結果、4日間で生産されたコハク酸、フマル酸、リンゴ酸の合計は、それぞれ、4.2, 2.7, 4.6 g/Lとなりました(図3)。これは、これまで知られているラン藻で生産量の最高記録です。また、発酵前に細胞内に蓄積されたグリコーゲンと、発酵後に生産されたカルボン酸を比べると、19 g/Lでほぼ同じ量であることがわかりました(図3)。この結果は、CitHox株は、効率的にグリコーゲンをジカルボン酸に変換できる発酵に適した株であることを示しています。ただし、ストリッピング法では培地を交換するための労力や費用がかかるため、今後はより効率的に生産の阻害となる要因を取り除くことが必要です。
研究チームは、ラン藻の遺伝子改変と発酵法の改良により、世界最高レベルでのジカルボン酸生産に成功しました。現時点では、副生成物として酢酸など生産されるため、今後は、ジカルボン酸の生産割合が高い株を作製していくことが必要です。また、ストリッピング法は労力と費用がかかるため、これに代わる安価な発酵法の開発も重要です。
今回の研究では、コハク酸の生産に、MDHという酵素の改変が重要であることを明らかにしました。このMDHは、過去に研究チームがコハク酸を作る方向に働くことを、試験管内で示した酵素です注3)。また、コハク酸の存在が、発酵によるコハク酸の生産に阻害となることも示しましたが、研究チームはコハク酸の生産途中の酵素が、コハク酸によって活性が低下することも示しています注4)。このように、試験管内での実験結果(in vitro)と、細胞での実験結果(in vivo)が一致することを明らかにしました。細胞での実験は時間がかかりますが、このような結果を受けて、試験管内で実験が有効であることがわかりました。
今後は、試験管内と細胞を使った両方の実験を効率的に進め、より高い効率でジカルボン酸を作る株を作製していくことが重要です。このような研究を進めることで、二酸化炭素を利用したバイオプラ原料生産の実用化が進むことが期待されます。
<タイトル>
Four-carbon dicarboxylic acid production through the reductive branch of the open cyanobacterial tricarboxylic acid cycle in Synechocystis sp. PCC 6803.
(日本語タイトル 還元的クエン酸回路を利用したラン藻のC4ジカルボン酸生産)
<著者名>
Hiroko Iijima, Atsuko Watanabe, Haruna Sukigara, Kaori Iwazumi, Tomokazu Shirai, Akihiko Kondo, Takash Osanai
<雑誌>
Metabolic Engineering
<DOI>
doi: 10.1016/j.ymben.2021.03.007
注1)シネコシスティス
世界的に研究されている淡水性、単細胞性のラン藻である。他の微細藻類に比べて増殖が速く、遺伝子組換えや凍結保存が可能といった利点を有する。全生物の中で、3番目に全ゲノムが決定されたモデル生物でもある。
注2)コハク酸生産のプレスリリース
遺伝子改変でプラスチック原料「バイオコハク酸」が5倍増 -ラン藻の光合成の力で二酸化炭素を工業原料へ- 2015年9月24日 明治大学
注3)リンゴ酸デヒドロゲナーゼMDHのプレスリリース
クエン酸回路の流れに著しく逆行する酵素の発見 2018年6月15日 明治大学
注4)フマラーゼFumCのプレスリリース
リンゴ酸生産酵素がコハク酸生産の鍵酵素の一つであることを示唆
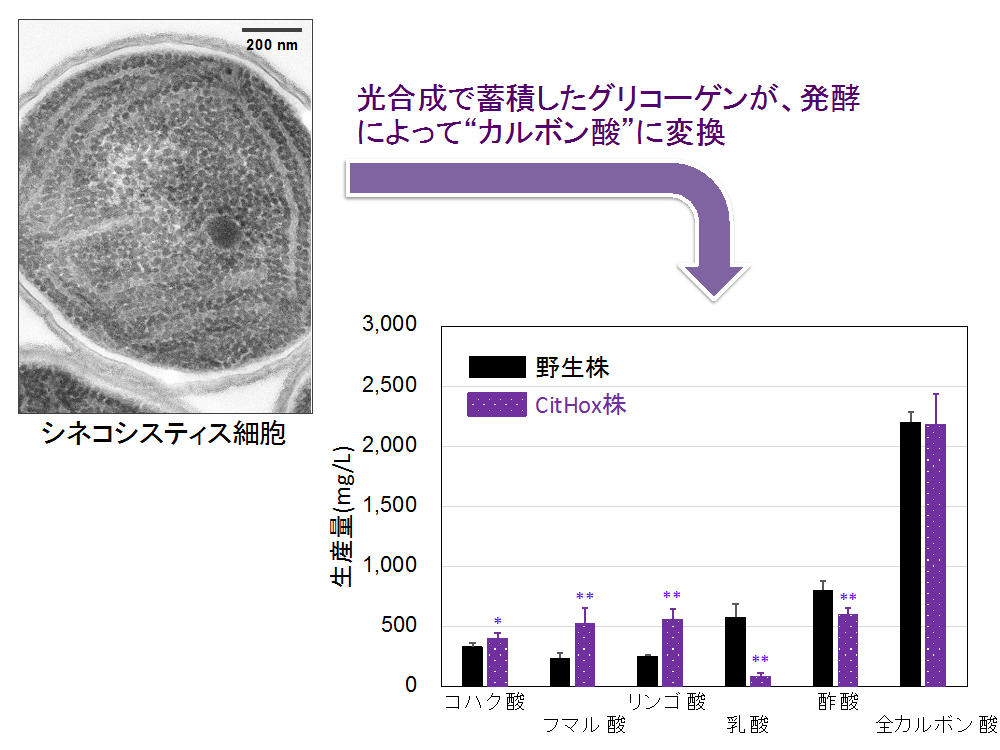
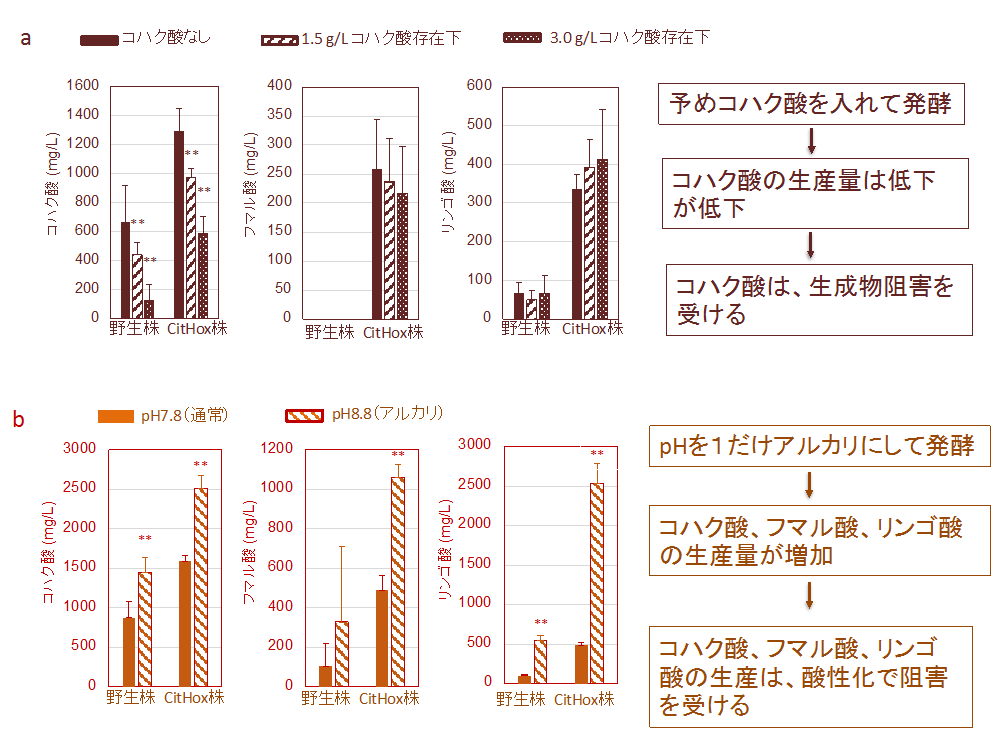
図2. 細胞外のカルボン酸生産量と生産阻害要因の探索
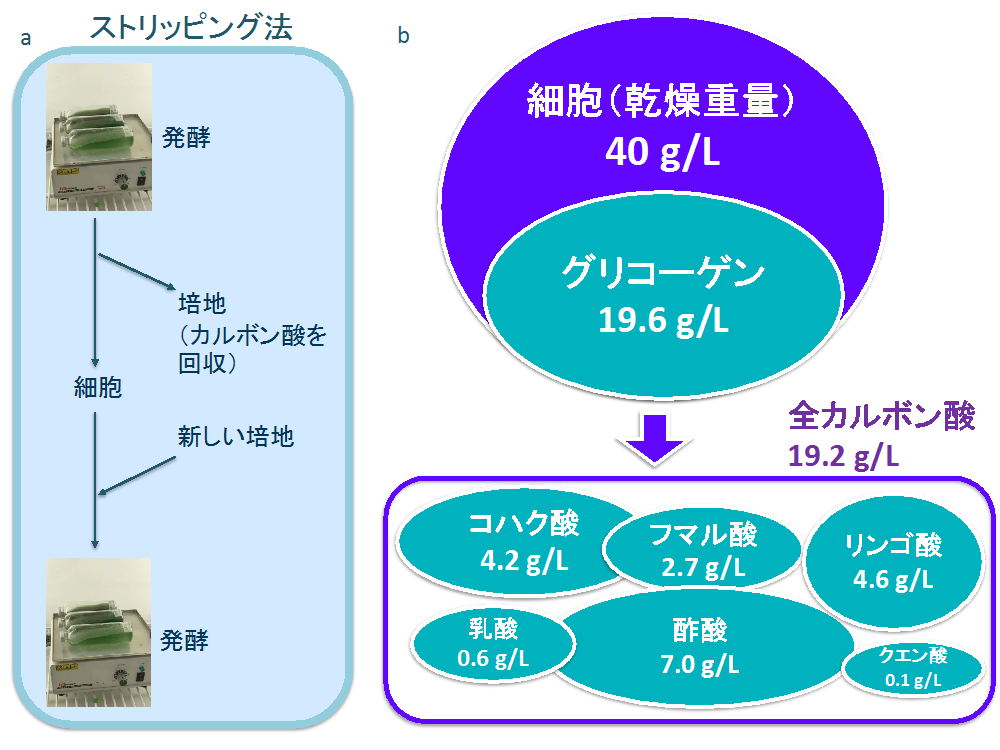
図3. ストリッピング法を用いたカルボン酸生産
明治大学農学部農芸化学科環境バイオテクノロジー研究室の小山内崇(准教授)、飯嶋寛子(専門研究員)、理化学研究所環境資源科学研究センター近藤昭彦(副センター長、神戸大学教授)、白井智量(副チームリーダー)らの研究グループは、光合成を行うバクテリアであるラン藻を用いて、二酸化炭素からのプラスチック原料生産を行っています。今回の研究では、ラン藻が作るプラ原料であるコハク酸の生産量を世界最高レベルに向上させました。
● ラン藻は酸素のない発酵条件で、プラ原料であるコハク酸などの化合物を細胞外に放出する。
● コハク酸生産に関わる酵素の遺伝子改変と、発酵法の改良を組み合わせ、コハク酸の生産量を向上させた。
● 発酵時の生成物や培地の酸性化が、コハク酸生産の抑制要因となっていることが明らかになったため、今後はさらなる培養方法の改変で、プラ原料生産の向上が期待される。
要旨
ラン藻の細胞内では、光合成で取り込まれた二酸化炭素は、グリコーゲンという糖の形で蓄積されます。このグリコーゲンは炭素の貯蔵源であり、細胞内で様々な化合物に変換されます。過去に研究チームは、シネコシスティスを発酵させることで、細胞内のグリコーゲンが、コハク酸や乳酸などの化合物に変換されることを発見しました。しかも、発酵中に生成されたコハク酸や乳酸は、細胞外に排出されるため、細胞を壊すことなく取り出すことができます。このコハク酸や乳酸は、バイオプラの原料となる物質です。これらの化合物からできたプラスチックは生分解性もあることから、環境技術への応用が期待されています。また、コハク酸に類似した化合物であるフマル酸やリンゴ酸も様々な化学工業原料として使われます。コハク酸、フマル酸、リンゴ酸は、2つのカルボキシル基(-COOH)を持つ化合物であることから、まとめて「ジカルボン酸」と呼ばれています。
今回研究チームは、遺伝子改変と発酵法の工夫により、コハク酸などのプラ原料の生産量を向上させることに成功しました。リンゴ酸デヒドロゲナーゼ(MDH)は、コハク酸を生産する前段階の反応を触媒する酵素です。研究チームは、このMDH(遺伝子名citH)を細胞内で増やした遺伝子改変株(CitHox株)を作製しました。このCitHox株を発酵させたところ、細胞外に放出されるコハク酸、フマル酸、リンゴ酸の3つのジカルボン酸の量が増えることがわかりました。
さらに研究チームは、発酵時の細胞量を増加させると、コハク酸などの生産量が増加することがわかりました。しかし、細胞量を増やした割には生産量が上がらなかったため、その原因を調べたところ、コハク酸の生産が、生成されたコハク酸そのものと培地の酸性化で、抑制されることを見出しました。この生産抑制を避けるため、研究チームは発酵中に培地を交換する“ストリッピング法”を開発しました。このストリッピング法を試したところ、コハク酸、フマル酸、リンゴ酸の量がそれぞれ4.2, 2.7, 4.6 g/Lで生産されました。これは、ラン藻を用いたジカルボン酸生産の最高記録であり、この結果より、二酸化炭素から効率的に付加価値のある化合物が生産できる可能性が示されました。
この研究は、明治大学農学部 小山内崇(准教授)、飯嶋寛子(専門研究員)、理化学研究所環境資源科学研究センター近藤昭彦(チームリーダー、神戸大学教授)、白井智量(副チームリーダー)らによって行われました。この研究は、JST戦略的創造研究推進事業先端的低炭素化技術開発ALCA,科研費基盤B、挑戦的研究萌芽(代表小山内崇)およびJSPS科研費新学術領域研究「新光合成」(領域代表基礎生物学研究所皆川純教授、計画班代表大阪大学清水浩教授)の援助により行われました。本研究成果は、2021年3月17日発行の米国科学誌「Metabolic Engineering」のオンライン版に掲載されました。
※研究グループ
明治大学 農学部農芸化学科
環境バイオテクノロジー研究室
准教授 小山内 崇(おさない たかし)
専門研究員 飯嶋 寛子(いいじま ひろこ)
理化学研究所 環境資源科学研究センター
細胞生産研究チーム
チームリーダー 近藤 昭彦(こんどう あきひこ)(副センター長、神戸大学教授)
副チームリーダー 白井 智量(しらい とものり)
明治大学 農学部農芸化学科
環境バイオテクノロジー研究室
准教授 小山内 崇(おさない たかし)
専門研究員 飯嶋 寛子(いいじま ひろこ)
理化学研究所 環境資源科学研究センター
細胞生産研究チーム
チームリーダー 近藤 昭彦(こんどう あきひこ)(副センター長、神戸大学教授)
副チームリーダー 白井 智量(しらい とものり)
1.背景
植物、藻類、細菌が行うことができる光合成は、光エネルギーを用いて大気中の二酸化炭素を細胞内に取り込む反応です。光合成では、二酸化炭素を取り込むことで、グリコーゲンやデンプンといった糖を作ります。これらの糖は、炭素の貯蔵源であり、光合成をする生物は必要に応じてこの糖を様々な化合物に変換します。光合成というと植物が最も有名ですが、藻類や細菌なども光合成を行うことができます。光合成を行う生物の中で、最も増殖が速く、扱いやすいのがラン藻です。ラン藻は、細菌であり、別名シアノバクテリア、アオコとも呼ばれています。ラン藻は光合成によってグリコーゲンを蓄積し、必要に応じて様々な化合物を作り出します。
ラン藻の中でも最も研究されているのが、シネコシスティス(Synechocystis sp.)というラン藻です。シネコシスティスは増殖が速いだけではなく、遺伝子の改変が可能であることから、遺伝子改変株を作製したバイオテクノロジーに利用することができます。過去に研究チームは、このシネコシスティスを発酵させることで、蓄積したグリコーゲンがコハク酸や乳酸などの有機酸に変換されることを発見しました注2)。発酵とは、外部の酸素を除いて培養することです。酵母の発酵ではエタノール、乳酸菌の発酵では乳酸が作られることはよく知られています。シネコシスティスの発酵では、コハク酸や乳酸が作られ、これらは細胞外に放出されます。細胞外に放出されるということは、作られた物質を集める際に細胞を壊す必要がないことを意味します。すなわち、シネコシスティスは、コハク酸や乳酸などを作るのに適した生物であることがわかります。
コハク酸は、炭素が4つの化合物であり、カルボキシ基(-COOH)を2つ持つ物質です。カルボキシ基を持つ物質は、まとめてカルボン酸と呼ばれます。コハク酸はこの2つのカルボキシ基を持つため、ジカルボン酸と呼ばれています。4つの炭素を持つジカルボン酸には、他にもフマル酸やリンゴ酸などがあります。これらコハク酸、フマル酸、リンゴ酸などのジカルボン酸は、バイオプラ原料、他の化合物を作る原料、酸味料、pH調整剤など、工業や食品で幅広く使われます。特にコハク酸は、フィルムや一般的なプラスチック製品に使われるポリブチレンサクシネート(PBS)というプラスチック原料になります。PBSは、生分解性を有するプラスチックです。これまでこのPBSは石油を原料として作られてきましたが、近年は生物を使ったバイオPBS生産が、世界的な競争になっています。このように、コハク酸をはじめとするジカルボン酸の生産の研究開発は、バイオテクノロジーの分野で非常に有望な分野と言えます。
今回研究チームは、遺伝子改変と発酵法の改良することで、シネコシスティスを用いたジカルボン酸の増産に成功しました。また、コハク酸の生産阻害要因などを明らかにし、ジカルボン酸の生産メカニズムについても明らかにしました。
2.研究手法と成果
まず、遺伝子改変していない野生株とCitHox株を、光を当てた条件で培養して光合成をさせ、グリコーゲンを蓄積させました。培養条件などを調節することで、野生株とCitHox株の両株は、細胞の乾燥重量の約50%のグリコーゲンを蓄積できることがわかりました(図1)。このグリコーゲンが蓄積した細胞を発酵条件で培養しました。発酵は、細胞を濃縮してバイアル瓶につめ、窒素で酸素を追い出すことで、低酸素条件にします。この後、ゴム栓で密閉し、アルミホイルで瓶を包むことで、酸素がない発酵条件となります。
最初は、遺伝子改変の効果を調べるために、細胞量を少なくして発酵を行いました。3日間の発酵後に、細胞外に放出されたカルボン酸の量を調べたところ、コハク酸、フマル酸、リンゴ酸の3つのジカルボン酸が、CitHox株では野生株よりも多いことがわかりました(図1)。反対に、乳酸と酢酸の量は、CitHox株では野生株よりも少ないことが明らかになり(図1)、この株は、炭素が4つのジカルボン酸を生産することに適した株であることがわかりました。
次に、さらにジカルボン酸の生産量を上げるために、研究チームは、発酵に使う細胞量を増やした高密度条件でのラン藻の発酵を行いました。高密度で発酵させることで、必要な培養液の量が減るとともに生成物も回収しやすくなるため、より実用的になります。研究チームが、細胞量を10倍にして発酵を行ったところ、生産されるジカルボン酸の量は増えましたが、10倍にはなりませんでした。このため、高密度にした際には、何らかの要因でジカルボン酸の生産が阻害されていることが示唆されました。
研究チームは、ジカルボン酸の生産の阻害要因として、2つの可能性を考えました。1つ目は生成物阻害と呼ばれる現象で、その名の通り、生成された物質(今回の場合はカルボン酸)が、途中の反応を妨害したり、細胞にダメージを与えるなどすることにより、生産量が低下させるというものです。2つ目は、培地の酸性化です。発酵によってラン藻が生産する物質はカルボン酸ですが、文字通り、これらは“酸”であるため、発酵中に培地を酸性化させます。このpHの酸性化は、発酵に大きな影響を与えることが知られていますが、今回の場合は溶液中の炭素のイオン化状態が変化するため、ジカルボン酸の生産量が低下することが予想されました。
そこで研究チームは2つの実験を行いました。まず、予めコハク酸(正確にはコハク酸ナトリウム)を入れておきながら発酵させ、コハク酸による生成物阻害を調べる実験です。この結果、コハク酸があると、発酵時のコハク酸生産量が低下することがわかりました(図2a)。一方、フマル酸やリンゴ酸は生産量が低下しませんでした(図2a)。次に、発酵を通常のpH7.8からpH=1だけアルカリにしたpH8.8の条件で発酵を行いました。その結果、コハク酸、フマル酸、リンゴ酸の3つの生産量が増加しました(図2b)。このように、コハク酸、フマル酸、リンゴ酸に関しては、培地の酸性化が生産の阻害となっていることがわかりました。pHを8.8にした条件では、CitHox株で、コハク酸の生産量が2.5 g/Lと、非常に高いレベルであることが明らかになりました(図2b)。
このように、発酵中の生成物や酸性化によってコハク酸などの生産量が落ちることがわかったため、研究チームは、発酵中に培地を新しくする“ストリッピング法”を開発しました。このストリッピング法では、1日ごとに発酵の培地を新しくして、合計4日間発酵させました(図3)。その結果、4日間で生産されたコハク酸、フマル酸、リンゴ酸の合計は、それぞれ、4.2, 2.7, 4.6 g/Lとなりました(図3)。これは、これまで知られているラン藻で生産量の最高記録です。また、発酵前に細胞内に蓄積されたグリコーゲンと、発酵後に生産されたカルボン酸を比べると、19 g/Lでほぼ同じ量であることがわかりました(図3)。この結果は、CitHox株は、効率的にグリコーゲンをジカルボン酸に変換できる発酵に適した株であることを示しています。ただし、ストリッピング法では培地を交換するための労力や費用がかかるため、今後はより効率的に生産の阻害となる要因を取り除くことが必要です。
3.今後の期待
今回の研究では、コハク酸の生産に、MDHという酵素の改変が重要であることを明らかにしました。このMDHは、過去に研究チームがコハク酸を作る方向に働くことを、試験管内で示した酵素です注3)。また、コハク酸の存在が、発酵によるコハク酸の生産に阻害となることも示しましたが、研究チームはコハク酸の生産途中の酵素が、コハク酸によって活性が低下することも示しています注4)。このように、試験管内での実験結果(in vitro)と、細胞での実験結果(in vivo)が一致することを明らかにしました。細胞での実験は時間がかかりますが、このような結果を受けて、試験管内で実験が有効であることがわかりました。
今後は、試験管内と細胞を使った両方の実験を効率的に進め、より高い効率でジカルボン酸を作る株を作製していくことが重要です。このような研究を進めることで、二酸化炭素を利用したバイオプラ原料生産の実用化が進むことが期待されます。
4.論文情報
Four-carbon dicarboxylic acid production through the reductive branch of the open cyanobacterial tricarboxylic acid cycle in Synechocystis sp. PCC 6803.
(日本語タイトル 還元的クエン酸回路を利用したラン藻のC4ジカルボン酸生産)
<著者名>
Hiroko Iijima, Atsuko Watanabe, Haruna Sukigara, Kaori Iwazumi, Tomokazu Shirai, Akihiko Kondo, Takash Osanai
<雑誌>
Metabolic Engineering
<DOI>
doi: 10.1016/j.ymben.2021.03.007
5.補足説明
世界的に研究されている淡水性、単細胞性のラン藻である。他の微細藻類に比べて増殖が速く、遺伝子組換えや凍結保存が可能といった利点を有する。全生物の中で、3番目に全ゲノムが決定されたモデル生物でもある。
注2)コハク酸生産のプレスリリース
遺伝子改変でプラスチック原料「バイオコハク酸」が5倍増 -ラン藻の光合成の力で二酸化炭素を工業原料へ- 2015年9月24日 明治大学
注3)リンゴ酸デヒドロゲナーゼMDHのプレスリリース
クエン酸回路の流れに著しく逆行する酵素の発見 2018年6月15日 明治大学
注4)フマラーゼFumCのプレスリリース
リンゴ酸生産酵素がコハク酸生産の鍵酵素の一つであることを示唆

図1. シネコシスティスにおけるグリコーゲンからカルボン酸への変換
シネコシスティスは、光合成でグリコーゲンを貯めることができる。左図はグリコーゲンが50%程度蓄積したシネコシスティス細胞。この蓄積されたグリコーゲンは、発酵によってカルボン酸に変換される。細胞外に放出されたカルボン酸の量(黒が野生株、紫がCitHox株)。図は、6回の実験データの平均と標準偏差の値を示したグラフ(*P<0.05,**P<0.005)。

図2. 細胞外のカルボン酸生産量と生産阻害要因の探索
a. 生成物阻害について 予めコハク酸ナトリウムを入れて発酵を行った。図1の10倍の細胞量を用いて発酵を行い、3日後に細胞外に放出されたカルボン酸の量を測定した。加えたコハク酸ナトリウムの量は差し引いてある。
b. 培地の酸性化について 通常のpH7.8よりに替え、pH8.8にした条件で、発酵を行った。図1の10倍の細胞量を用いて発酵を行い、3日後に細胞外に放出されたカルボン酸の量を測定した。図は、3〜4回の実験データの平均と標準偏差の値を示したグラフ(**P<0.005)
b. 培地の酸性化について 通常のpH7.8よりに替え、pH8.8にした条件で、発酵を行った。図1の10倍の細胞量を用いて発酵を行い、3日後に細胞外に放出されたカルボン酸の量を測定した。図は、3〜4回の実験データの平均と標準偏差の値を示したグラフ(**P<0.005)

図3. ストリッピング法を用いたカルボン酸生産
a. ストリッピング法について 発酵させたラン藻を1日ごとに培地と細胞に分けた。培地のカルボン酸を定量するとともに、細胞は新しい培地に懸濁して発酵を再開した。
b. ストリッピング法を用いて発酵させたCitHox株の代謝変化。4日間発酵させ、1日ごとにストリッピング操作を行った。図1の10倍の細胞量(乾燥重量約40 g/L)を用いて発酵を行い、細胞外に放出されたカルボン酸の量の合計を表す。グリコーゲンは、発酵前に細胞内に蓄積された量である。3〜4回の実験データの平均の値。
b. ストリッピング法を用いて発酵させたCitHox株の代謝変化。4日間発酵させ、1日ごとにストリッピング操作を行った。図1の10倍の細胞量(乾燥重量約40 g/L)を用いて発酵を行い、細胞外に放出されたカルボン酸の量の合計を表す。グリコーゲンは、発酵前に細胞内に蓄積された量である。3〜4回の実験データの平均の値。
- お問い合わせ先
-
発表者(研究内容)について
明治大学 農学部農芸化学科 環境バイオテクノロジー研究室准教授
小山内 崇(おさない たかし)
TEL:044-934-7103
FAX:044-934-7103
-
取材について
明治大学 経営企画部 広報課
〒101-8301 東京都千代田区神田駿河台1-1
TEL:03-3296-4082
FAX:03-3296-4087
E-mail:koho@mics.meiji.ac.jp


